作者:雷舒涵
来源:药学院
编辑:伍恒犁
日期:2025-03-31 阅读:1
新闻网讯 近日,药学院董辉教授与彭晓娉副教授联合团队在微生物源天然产物抗胃癌机制研究领域取得重要突破。其研究成果“Fungal dimeric xanthones as anticancer agents by novelly stimulating sodium-calcium exchanger 1”(DOI:10.1016/j.ejmech.2025.117543)发表于药物化学领域的经典顶级期刊《European Journal of Medicinal Chemistry》(中科院医学2区,药物化学1区,IF = 6.0)。该研究由硕士研究生周国龙、董克敏共同完成,董辉教授和彭晓娉副教授为共同通讯作者。
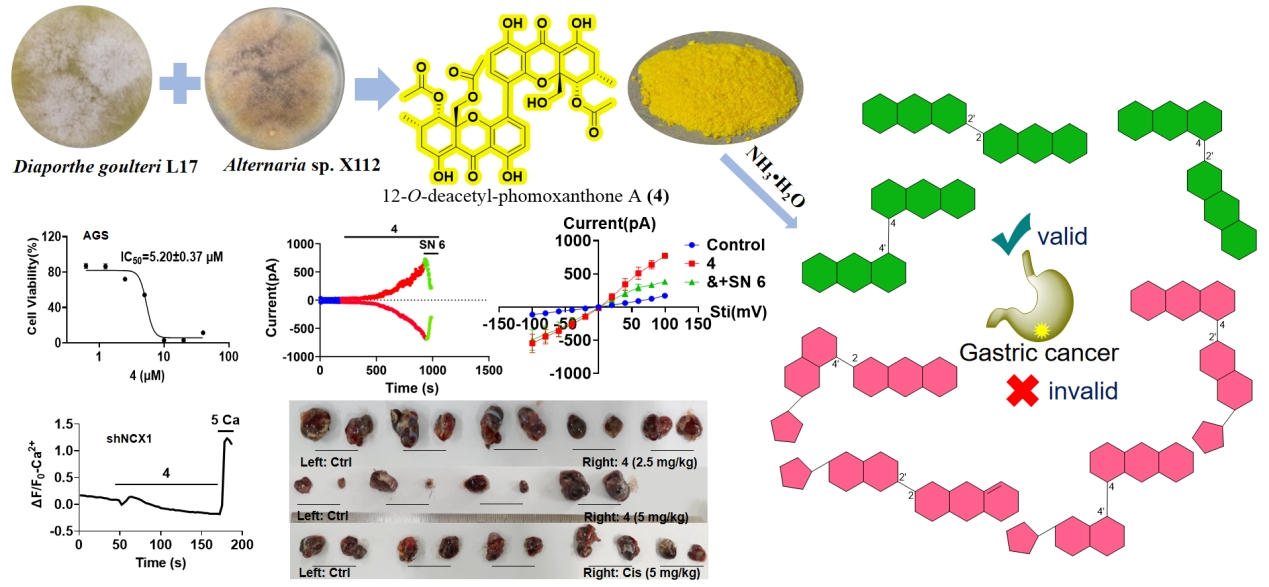
研究聚焦于氧杂蒽酮二聚体(Xanthone dimers,Xds)这一天然抗肿瘤活性分子。团队创新性地采用真菌“前体导向”共培养技术,大幅度提高了Xds的代谢产量,并使用化学衍生策略进一步丰富了Xds的化学多样性。通过微生物发酵和结构衍生共获得了18个Xds,其中包括5个新结构。在化合物立体构型解析方面,研究团队攻克了Xds绝对构型鉴定的技术瓶颈,综合运用核Overhauser效应谱(NOESY)、电子圆二色谱(ECD)、TDDFT-ECD理论计算以及化学沟通策略等,建立了系统的结构鉴定方法体系。通过CCK-8法体外抗肿瘤活性测试构建的构效关系(SPR)表明,氧杂蒽酮-氧杂蒽酮骨架的Xds对人胃癌细胞表现出显著的抗增殖活性,而对人结肠癌细胞无活性。活性Xds对胃癌细胞的体外抗增殖效力较阳性对照药物顺铂提升了2至5倍,而且Xds对胃癌细胞的抑制作用显著高于正常细胞。
Xds通过特异性激动钠钙交换体1(NCX1)的反向转运模式促进细胞外钙内流,从而发挥抗胃癌作用。在前期董辉教授团队发现NCX1的Ca2+调控与胃癌发生发展密切相关的基础上,本研究进一步证实NCX1反向转运模式的抗胃癌作用及其分子机制。通过单细胞内钙信号测定、电生理膜片钳技术、分子生物学实验及分子对接技术,反复确认了NCX1是Xds对胃癌细胞作用的主要靶点。进一步研究揭示活性Xds通过激动NCX1,显著增强细胞内Ca²⁺浓度,抑制下游PI3K/AKT/β-catenin信号通路,最终导致胃癌细胞死亡。同时,细胞实验表明,活性Xds通过抑制AGS细胞迁移、诱导细胞凋亡和G1期阻滞抑制胃癌细胞的增殖,显示出Xds作为潜在抗肿瘤药物的作用及机制。此外,与抗胃癌活性及机制相似,Xds类化合物在体外和体内模型中也显示出抗皮肤黑色素瘤活性。
计算机模拟分子对接显示Xds具有提高与NCX1靶点结合力,进而增强抗胃癌活性的潜力。由于迄今国际市场尚无商品化的NCX1特异性激动剂面世,使得NCX1的生理及病理学研究明显滞后。因此,本研究不仅研发新的NCX1反向转运模式特异性激动剂,而且证实其体内外抗胃癌及皮肤癌的作用和分子机制,并具有潜在的临床应用价值。我们将在未来通过计算机辅助药物设计与多样性导向合成的策略,对Xds分子进行结构优化,进一步提升抗癌活性与靶向选择性;为深入挖掘Xds结构类型的靶向抗癌活性先导化合物奠定基础。
责任编辑:杨伦