作者:雷舒涵
来源:药学院
编辑:伍恒犁
日期:2025-03-14 阅读:1
新闻网讯 近日,我校药学院药理学系董辉教授团队在结肠癌研究领域取得重要研究进展,相关研究成果以“NCX1 interacts with TRPA1 to promote cell proliferation and tumorgrowth of colon cancer via disruption of calcium homeostasis”为题发表在国际权威期刊《Journal of Advanced Research》(中国科学院期刊1区top期刊,IF=11.4)。该研究由药学院硕士研究生周立勇和周国龙共同完成,董辉和郭瑞红老师为共同通讯作者,青岛大学为唯一完成单位。
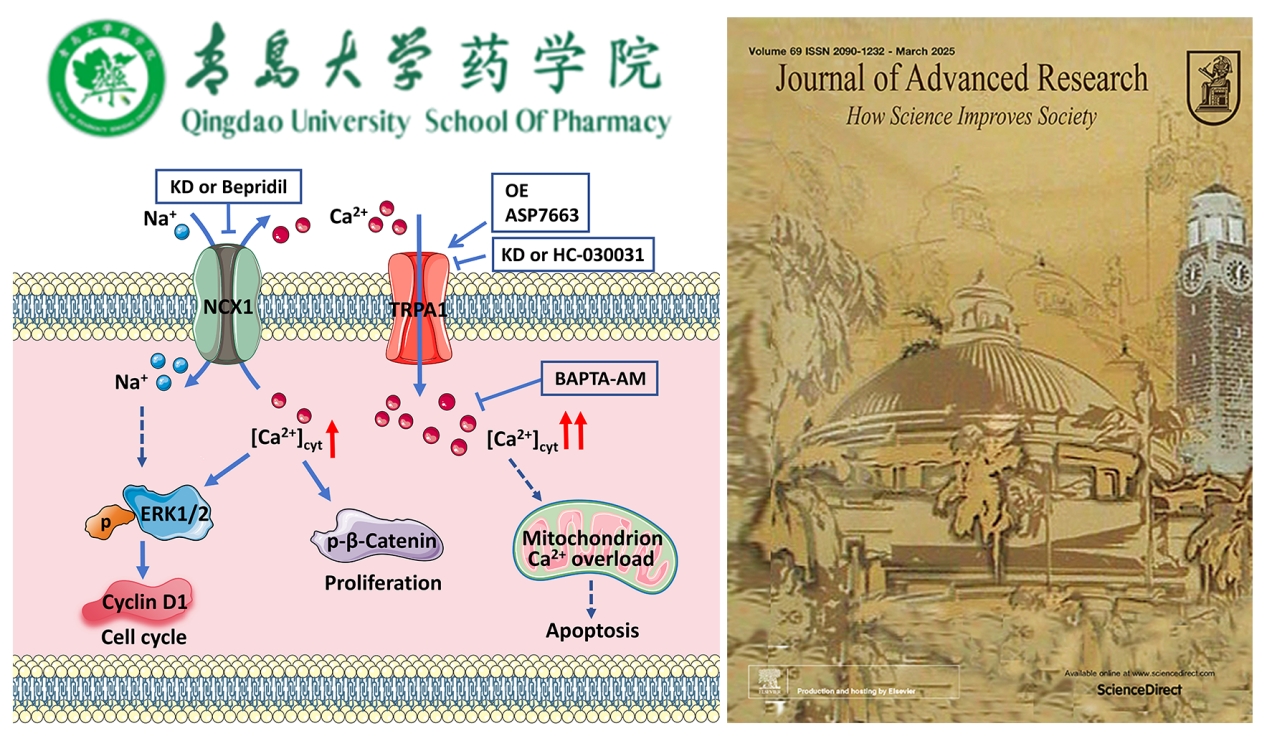
细胞浆内Ca2+信号([Ca2+]cyt)的异常在肿瘤发生、发展中至关重要。Na+/Ca2+交换器1(NCX1)作为双向Na+和Ca2+转运体,可在Ca2+进入或排出模式下工作,而瞬时受体电位锚蛋白1(TRPA1)作为可渗透Ca2+的细胞膜通道,能够介导Ca2+内流。二者在维持肿瘤细胞的[Ca2+]cyt稳态及其肿瘤细胞的命运中均发挥关键作用。尽管已有研究表明NCX1和TRPA1与某些肿瘤的发生及发展有关,但它们在结肠癌发病机制中的潜在作用尚未被阐明。该团队首次揭示了NCX1与TRPA1的偶联机制及其在结肠癌发展中的关键作用。
既往对细胞膜上可渗透Ca2+的通道与肿瘤细胞命运的研究,多关注于单一离子通道蛋白的作用。然而,在真实世界里细胞膜上表达多种离子通道和转运蛋白并同时发挥功能效应。例如,已知TRPA1通道开放会导致过量Ca2+内流,从而促进结肠癌细胞的凋亡,但未能解释结肠癌细胞膜上的TRPA1通道蛋白表达及功能明显增强,为何结肠癌却依然能够发生发展这一关键事实。在国家自然科学基金委和青岛大学的支持下,董辉教授团队经过长期系统性研究,首次提出了“钙信号动态平衡模型”:尽管TRPA1通道开放会导致过量Ca2+内流,但大部分内流的Ca2+通过NCX1钙外排机制又被排出细胞。这种精密的偶联机制,使[Ca2+]cyt处于适当浓度而维持在一个“促癌窗口”—使肿瘤细胞内的Ca2+信号持续激活下游致癌信号通路却又不足以触发细胞凋亡。这不仅完美解释了为何共定位在结肠癌细胞膜上的TRPA1和NCX1蛋白表达及功能平行增强,而且发现了一条肿瘤细胞逃逸凋亡的全新机制及其生存策略。当阻断NCX1的Ca2+排出模式或TRPA1通道时通过抑制下游信号通路ERK1/2和β-catenin的特异性磷酸化,从而发挥抗肿瘤细胞的增殖作用。这一成果颠覆了传统认知,证明离子通道并非孤立的功能单元,而是构成了复杂调控网络的‘信号枢纽’。这一创新视角将会推动肿瘤治疗进入“离子通道靶向时代”。尽管目前对NCX和TRP通道的研究在肿瘤学领域仍处于初期阶段,但它们蕴含的研究潜力有望在肿瘤治疗中实现新的突破
责任编辑:杨伦